杨浦区赋悦科技eCTD欢迎选购
中国将进一步与国际接轨,推进eCTD等标准应用,提高药品注册效率和质量。AI技术可能在药品注册领域广泛应用,如辅助审评人员工作。未来药品注册资料将更注重结构化数据,有助于监管机构高效获取和利用数据。 eCTD等数字化工具将推动药品监管向智慧监管和全生命周期监管发展,提高监管效率和质量。区块链技术具有应用前景,可构建全球统一的药品申报数据平台。数据化时代,药品注册领域将更注重数据收集、分析和利用,为监管机构和企业提供决策支持。 总而言之,展望未来,随着eCTD在药品注册领域的广泛应用和不断发展,中国将逐步建立起与国际接轨的药品注册体系。这将有助于提高中国药品注册的效率和质量,推动中国药品走向世界舞台。同时,企业也需要密切关注技术发展动态和监管政策变化,及时调整自身战略和规划,以适应未来的市场竞争和监管要求。澳大利亚ANDA注册申报相关技术支持。杨浦区赋悦科技eCTD欢迎选购
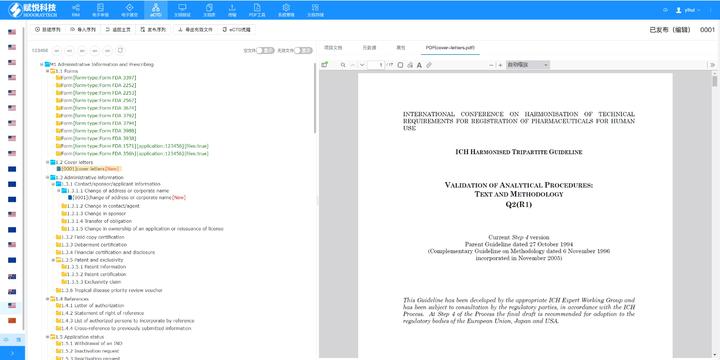
多国审评程序与eCTD递交途径的适配:欧盟药品审评程序包括集中(CP)、分散(DCP)、互认(MRP)和国家程序(NP),eCTD需适配不同程序的递交要求。例如: ?集中审评程序(CP)?:通过EMA的eSubmission Gateway提交,审评时限约240个工作日,eCTD需包含完整的模块1-5及多语言标签文件。 ?分散审评程序(DCP)?:需通过CESP(欧盟共同提交门户)递交,参考成员国(RMS)主导审评,eCTD需支持多国同步评估的模块化拆分。 ?互认程序(MRP)?:已授权成员国作为RMS,eCTD需包含基线序列(Baseline Sequence 0000)以整合历史审评数据,并通过CMDh协调分歧。徐汇区赋悦科技eCTD服务价格欧盟eCTD申报软件相关技术支持。
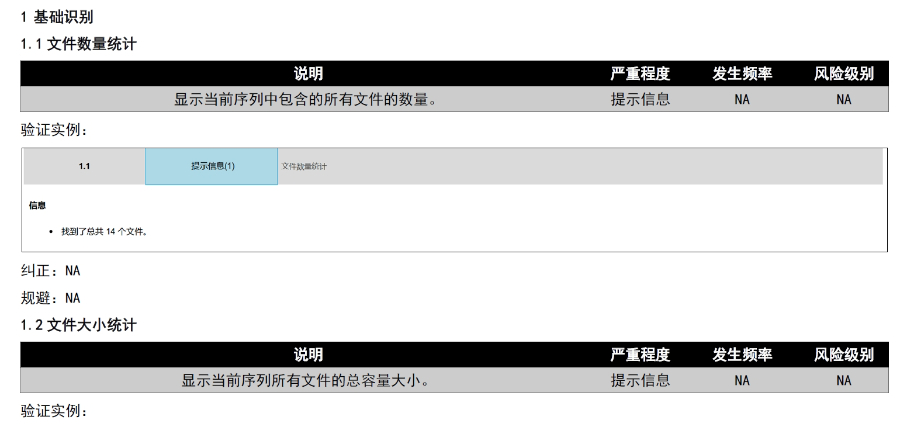
eCTD提交流程与ESG系统:FDA要求通过电子提交网关(ESG)传输eCTD文件,单个文件大小限制为10GB,超限需拆分或通过物理介质(如光盘)递交。提交前需预分配申请号(如NDA编号),并通过ESG测试账户验证技术合规性。序列号命名规则为4位数字(如0001),申请需从“原申请”序列开始,补充资料按递增顺序编号。企业可自愿提交预审样本(Pre-Submission),FDA将反馈文档结构、元数据等合规性问题。验证标准与常见错误类型:FDA验证标准分为高(High)、中(Medium)、低(Low)三级,高风险错误(如无效XML或缺失关键表格)必须修复,否则直接拒收。常见问题包括:重复序列号(错误1034)、文件路径超长(警告2015)、PDF加密或非标字体(错误4001)。2023年统计显示,30%的提交因模块1格式错误被退回,凸显行政信息合规的重要性。验证工具如LORENZ eValidator被FDA官方采用,可自动检测200+项技术指标。
赋悦Word插件 自主研发Word插件 快速编辑:整合word常用功能按钮,避免频繁切换菜单;内置标题、段落、文字、目录、超链接等的格式和样式,可快速设置和更文档的格式 快速链接:双击或者拖拽的方式,制作文本超链接或者题注超链接;可搜索全文关键字,自动制作超链接 文档拆分:可根据不同的条件将word文件颗粒化,如分节符、页眉、页脚、页码范围和自定义页码等 PDF转换:WORD转PDF,自动判断是否生成书签,自动镶嵌所有字体,生成PDF快速网页浏览的PDF,确保生成的PDF所有属性符合法规要求 文档验证:验证文档的字体、字号、纸张、页面布局、空白页、页码、编号、目录、超链接等,并且可以定位验证结果 可定制:可根据用户需求定制格式和样式模板澳大利亚DMF注册申报相关技术支持。

美国eCTD的强制实施时间与范围:美国自2017年5月5日起要求药申请(NDA)、仿制药申请(ANDA)和生物制品许可申请(BLA)必须通过eCTD格式提交,2018年5月5日进一步扩展至临床试验申请(IND)和药品主文件(DMF)。FDA通过《联邦食品、药品和化妆品法案》第745A条明确电子提交的强制性,豁免非商业化IND和部分DMF类型(如Ⅲ类)。2023年数据显示,FDA接收的eCTD申请占比已达92%,标志着电子化审评体系的成熟。企业若未按规范提交(如缺少文件或重复序列号),将直接被拒收。加拿大NDA注册申报相关技术支持。杨浦区赋悦科技eCTD欢迎选购
瑞士eCTD验证标准相关技术支持。杨浦区赋悦科技eCTD欢迎选购
欧盟eCTD的递交途径与技术要求 不同审评程序对应不同递交渠道:集中程序(CP)通过EMA的eSubmission Gateway或Web Client提交,分散程序(DCP)和互认程序(MRP)则需使用欧盟通用提交门户(CESP)。文件结构需严格遵循模块化要求,例如CEP申请需包含模块1(行政文件)、模块2(质量概述)和模块3(技术文档),且XML主干文件须符合EDQM的特定命名规则。此外,所有PDF文件需无密码保护、可全文检索,并嵌入层级书签以支持快速审阅。 CEP申请的eCTD递交特殊性 CEP程序自2018年起强制采用eCTD格式,重点评估原料药是否符合欧洲药典标准。其模块1需包含EDQM申请表、简历及变更说明表,模块2需使用EDQM提供的质量概述模板,模块3则按CTD格式组织3.2.S章节内容。CEP与ASMF(活性物质主文件)的主要区别在于性:CEP无需关联上市许可,且审评由EDQM完成。杨浦区赋悦科技eCTD欢迎选购
- 高新区中国eCTD欢迎选购 2025-05-14
- 静安区生物制品eCTD使用 2025-05-14
- 芜湖新药eCTD是什么 2025-05-14
- 吴江区赋悦科技eCTD供应商 2025-05-14
- 南京生物制品eCTD注册系统 2025-05-14
- 上海化学药品eCTD格式 2025-05-09
- 南京电子申报eCTD哪个品牌好 2025-05-09
- 太仓NDAeCTD服务价格 2025-05-09
- 浦东新区原料药eCTD文件如何制作 2025-04-26
- 南京新药eCTD找哪家 2025-04-26
- 湖南巡检养老机器人定制 2025-06-07
- 杭州消费电子类线束 2025-06-07
- 家校互联视频话机厂家批发 2025-06-07
- 淮安特殊光解膜厂家直销 2025-06-07
- 湖北正版ANSYS HFSS 2025-06-07
- 重型智能营销产品 2025-06-07
- 浙江RFID通道门销售公司 2025-06-07
- 无锡好的热塑性复合材料量大从优 2025-06-07
- 经销商营销获客方案订制 2025-06-07
- 河北工业机器人力控搬运 2025-06-07