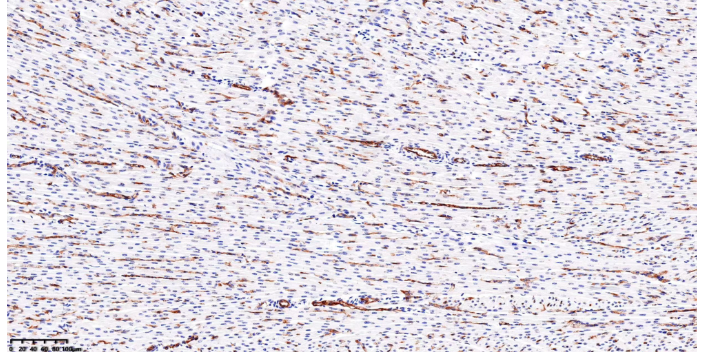
CD45免疫荧光
免疫荧光的制作:样品准备(贴壁细胞、悬浮细胞以及组织等):对于贴壁细胞:先将洁净的盖玻片在70%乙醇中进行浸泡处理,然后用干净无菌的镊子放置到培养皿中,用无菌PBS洗去残留的乙醇。待细胞接近长成单层后取出盖玻片,操作小心,防止细胞脱片。对于悬浮细胞:有2种方法,①先在悬浮液中进行固定步骤,然后把细胞滴加在载玻片上,干燥后细胞会紧贴在载玻片上。②先在悬浮液中进行固定和染色步骤,离心洗脱,然后用移液管移至盒式玻片进行后续染色步骤。对于冷冻切片:切片放置在载玻片上后,可以直接进行固定等后续操作。对于石蜡切片:免疫荧光中石蜡切片较少,要先进行脱蜡和抗原修复处理。免疫荧光技术可以通过荧光信号显示和检查细胞或组织内的抗原或半抗原物质。CD45免疫荧光
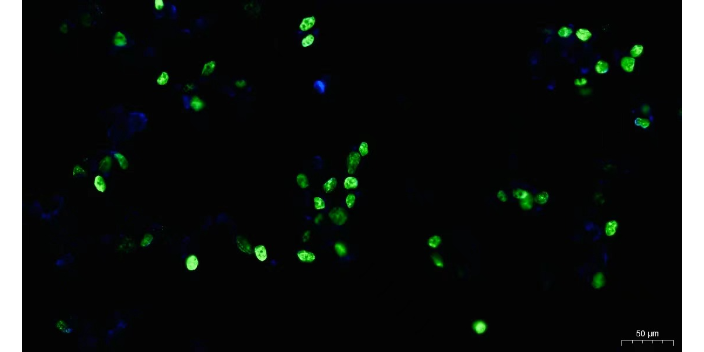
细胞的固定及免疫荧光:吸去一抗,使用PBS浸洗 3 次,每次 5 min。向孔内滴加足够量适宜浓度的二抗,37℃,室温避光孵育1小时。注意二抗带有荧光素标记,因此操作过程尽量在暗处进行。吸去二抗,使用PBS浸洗 3 次,每次 5 min。向玻片上滴加DAPI,或者Hoechst复染细胞核,一般为蓝色荧光;避光孵育5-10min。使用PBS轻洗细胞3 次,每次 5 min,洗去多余的DAPI。取爬片时由于爬片与培养皿底结合较紧,张力较大,可将注射器针头针尖向背面做个小钩,这样将爬片轻轻勾起,用小镊子取出即可。用吸水纸吸干爬片上的液体,用含抗荧光淬灭剂的封片液封片,注意将爬片反过来贴于多聚赖氨酸载玻片上,然后在荧光显微镜下观察并采集图像,注意选择抗体对应的激发光源。CD20免疫荧光检查免疫荧光是一种常用的生物学实验技术,用于检测和定位特定抗原或抗体。
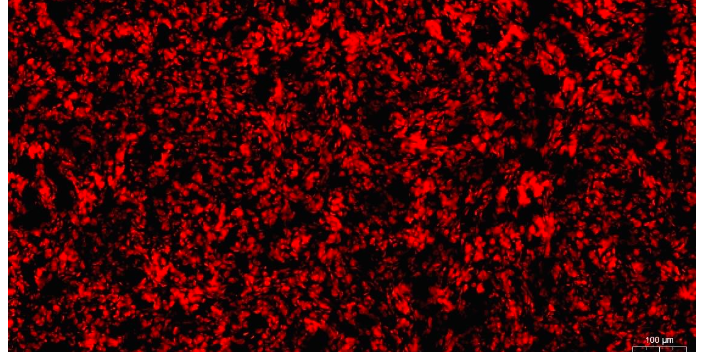
注意:从加荧光二抗起,后面所有操作步骤都尽量在较暗处进行.DAPI复染核:爬片置于PBS(PH7.4)中在脱色摇床上晃动洗涤3次,每次5min。切片稍甩干后在圈内滴加DAPI染液,避光室温孵育10min。封片:爬片置于PBS(PH7.4)中在脱色摇床上晃动洗涤3次,每次5min。玻片稍甩干后用抗荧光淬灭封片剂封片。镜检拍照:切片于荧光显微镜下观察并采集图像。(DAPI紫外激发波长330-380nm,发射波长420nm,发蓝光;FITC激发波长465-495nm,发射波长515-555nm,发绿光;CY3激发波长510-560,发射波长590nm,发红光)。两种抗体同时孵育:由于FIT容易萃灭,因此在孵育抗体时后孵育FITC二抗(孵育二抗一定要避光。
免疫荧光技术的主要特点是:特异性强、敏感性高、速度快。主要缺点是:非特异性染色问题尚未完全解决,结果判定的客观性不足,技术程序也还比较复杂。荧光免疫法按反应体系及定量方法不同,还可进一步分做若干种。与放射免疫法相比,荧光免疫法无放射性污染,并且大多操作简便,便于推广。国外生产的TDM用试剂盒,有相当一部分即属于此类,并且还有TDM荧光偏振免疫分析用的自动分析仪生产。由于一般荧光测定中的本底较高等问题,荧光免疫技术用于定量测定有一定困难。新发展了几种特殊的荧光免疫测定,与酶免疫测定和放射免疫分析一样,在临床检验中应用。荧光抗体法和荧光抗原法都属于免疫荧光技术的范畴。
细胞的固定及免疫荧光:注意事项:(1)取细胞爬片时,动作应轻柔,防止将细胞爬片夹碎,影响实验进程。(2)种细胞过程中,要注意将细胞轻柔混匀,“八”字或者“十”字形摇晃,防止细胞局部生长过密。(3)稀释、加二抗(荧光抗体)及此后的洗涤过程中注意避光。(4)细胞爬片进行免疫荧光之后,需要尽快拍照,防止免疫荧光淬灭。或者放于暗盒内,暂时保存于4度冰箱,尽快拍照。(5)在进行荧光显微镜拍照时,要根据荧光抗体选择合适的激发光源。PI/DAPI能将凋亡和未凋亡的细胞都染成红色/蓝色,只在凋亡的细胞核中才有FITC-12-dUTP掺入而定位的绿色荧光。在实际工作中,荧光抗原技术应用较少,因此通常将其称为荧光抗体技术或免疫荧光技术。CD20免疫荧光检查
免疫荧光技术可以用于研究心血管系统的疾病和医治。CD45免疫荧光
细胞和组织样品处理:准备荧光标记的细胞样品:为实现较佳的图像质量,首先应建立针对目的蛋白和细胞结构的研究,同时将其他一切背景等排除在图像之外。固定和破膜细胞样品用于标记–首先将细胞结构、蛋白和核酸固定,然后使荧光染料和抗体渗入到细胞内部,标记目的靶点。封闭细胞样品,防止荧光标记物与研究无关的蛋白非特异性结合,较大限度提高信噪比。蛋白封闭液有助于减少非特异染色。抗体能够取代封闭蛋白与其表位形成高亲和力结合,而封闭液可防止样品中的低亲和力结合。CD45免疫荧光
- Vimentin免疫荧光检查 2025-07-13
- 细胞实验计划 2025-07-13
- 浙江超微病理分析服务 2025-07-13
- 上海动物细胞病理实验服务 2025-07-13
- 动物订购服务 2025-07-13
- 江苏超微病理实验步骤 2025-07-13
- 江苏科学实验器材 2025-07-13
- 河北超微病理检验 2025-07-13
- 河北超微病理实验设计 2025-07-13
- 病理实验报告 2025-07-13
- 资产管理电子标签设计大概多少钱 2025-07-13
- 嘉善平台建设全网推广渠道 2025-07-13
- 陈作林陈记牛肉面加盟总部派技术吗 2025-07-13
- 珠海专业数据健康产业一站式服务 2025-07-13
- 绵阳智慧物流冻库设计 2025-07-13
- 厦门整柜拼箱海运物流 2025-07-13
- 临汾的制造行业通过云平台可以快速吸引目标受众的注意力 2025-07-13
- 潍坊青少年素质教育拓展课程 2025-07-13
- 达州冻库设计公司 2025-07-13
- 上海本地订单管理软件包括什么 2025-07-13