湖北结果客观的HE染色外包
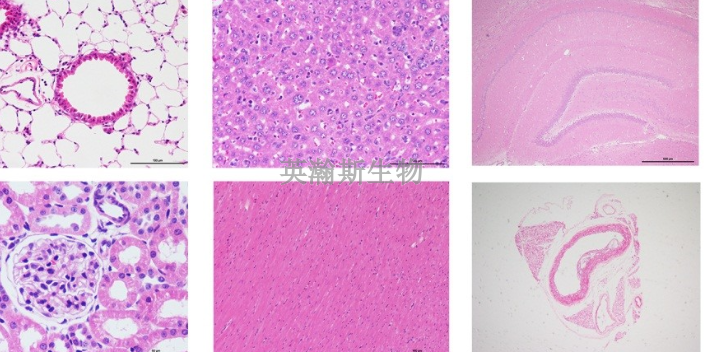
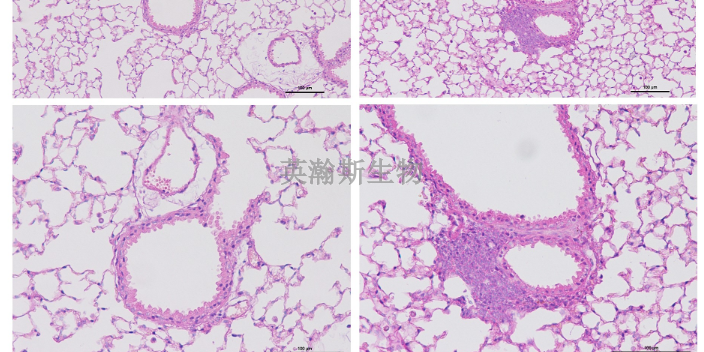
HE染色攻略:HE染色又称为苏木精-伊红染色,染色后组织或细胞可以借助普通光学显微镜观察与鉴别细胞凋亡与细胞坏死的一种染色方法。这种方法适用范围***,对组织细胞的各种成分都可着色,便于***观察组织构造,而且适用于各种固定液固定的材料,染色后不易褪色可长期保存。经过HE染色,细胞核被苏木素染成蓝紫色,细胞质被伊红染色呈粉红色。可以观察细胞结构、组织层次等等。首先切片组织是否完整,组织有无损伤;然后看切片有无刀痕;***细胞核是否清晰可见,胞核与包浆要对比鲜明。HE染色 ,石蜡切片技术里常用的染色法之一。湖北结果客观的HE染色外包

HE染色观察细胞凋亡,凋亡检测中形态学方法是**直观、可靠的方法之一。对组织和各种细胞进行染色后,在光学显微镜、荧光显微镜或电子显微镜下观察,通过观察细胞的形态或染色的类型来判断凋亡的发生与否。细胞涂片或细胞甩片的制备:对于贴壁细胞,可将盖玻片放于培养器皿中,让培养细胞长于玻片上,然后用药物诱导细胞凋亡后取出,用4%多聚甲醛固定5min。对于悬浮细胞,用药物诱导细胞凋亡后,离心1000r/min收集细胞,用PBS洗2次,收集调整细胞数为1X105/ml,涂片或用离心甩片,用4%多聚甲醛固定5min;在光学显微镜下,贴壁细胞由原来的梭形或多角形变小、变圆,核呈蓝色或蓝黑色,胞浆呈淡红色,核固缩、破碎,形成凋亡小体等。悬浮细胞,整个细胞皱缩,核固缩,破碎,形成凋亡小体,染色质颜色加深等。辽宁靠谱的HE染色公司骨组织HE染色的操作流程。
HE染色细胞核灰蓝原因:(1)组织处理温度过高、过热,在石蜡停留的时间过长;(2)固定时间太短,接下来就直接在高浓度的乙醇中行脱水处理。对策:理论上来说,加热处理*在组织浸蜡步骤才使用,组织不能在热的蜡液中停留过长时间。如果由于某些原因不能进行下步包埋处理,完成浸蜡处理后的组织,可将组织连同塑料包埋盒一并放置在室温空气中,冷却凝固,以备包埋。待需要包埋时再重新加温直至石蜡融化即可。组织在处理前必须确保固定良好,脱水比较好能从低浓度的乙醇开始。
HE染色多聚甲醛保存组织的注意事项:多聚甲醛放置过久其中的醛基可能会被氧化为酸,使溶液pH降低,从而影响染色。不同细胞或组织样品所需的固定时间有所不同,应当根据细胞或组织的种类以及组织块的大小来调整固定时间。多聚甲醛虽然作用温和,但能硬化组织,固定时间过久会导致组织变脆,切片时易碎。因此固定时间通常不宜超过24小时。多聚甲醛可长期存在于固定过的细胞或组织样品中,固定完成后用适当的洗涤液或水冲洗数小时仍会有残留,因此后续实验结果如果受醛基影响,须尽量洗去残留的多聚甲醛。醛基与抗原蛋白的氨基交联形成羧甲基,使抗原决定簇的三维构象出现空间障碍。分子间交联形成的网格结构可能部分或完全掩盖某些抗原决定簇,使之不能充分暴露,可造成假阴性的染色,影响免疫组化结果。因此,4%多聚甲醛固定的细胞或组织样品在进行免疫组化检测时,有时需要对抗原先进行修复,然后才能进行免疫染色等后续操作。冰冻切片是否可以做HE染色?
HE染色伊红着色淡分析及应对原因:(1)伊红染液的pH值可能大于5;(2)蓝化液残留过多;(3)切片太薄;(4)切片经伊红染色后在乙醇脱水时间过长。对策:检查伊红染液的pH值,如果必要的话,用乙酸将其调节在4~5之间,从而使伊红染色彩艳丽。确保每次蓝化步骤完成后,使用的弱碱性溶液被充分洗去,玻片上没有残留的弱碱性溶液。检查切片的厚度。脱水时不要让切片在低浓度乙醇停留时间过长,因为含水多的低浓度乙醇会将伊红的颜色分化掉。HE染色小攻略技巧分析。陕西比较好的HE染色价格
石蜡组织切片的HE染色。湖北结果客观的HE染色外包
HE染色常见问题:Q3:细胞核染色过浅,颜色暗淡答:切片在苏木素染液中停留过短,或苏木素过度氧化失效,或分化时间太长。对策:重新染色。将组织切片放入0.01%氢氧化钠、0.5%氨水、饱和的碳酸氢钠溶液、乙醇溶液,每个3-5min即可,接着重新染色。可以适当地组织的嗜碱性以增强核染色,如Zenker液固定的切片可放入5%碳酸氢钠溶液中3h,自来水冲洗5-10min染色,或Bouin液固定的切片可放入5%碳酸氢钠溶液中1h,自来水冲洗10min染色。Q4:细胞核染色过深,胞浆着蓝色答:切片在苏木素染液中停留过长;或切片太厚;或分化时间太短。这种情况首先镜下看看切片厚度(比较好厚度1-2层细胞核),要么重新染色,要么重新制片。南京英瀚斯,专业的病理染色实验服务平台。湖北结果客观的HE染色外包
- 湖南质量好的HE染色多少钱 2025-07-30
- 江苏结果客观的HE染色报告 2025-07-30
- 湖北值得信赖的HE染色哪家好 2025-07-30
- 海南靠谱的HE染色多少钱 2025-07-30
- 福建肺纤维化模型如何构建 2025-07-29
- 重庆病理HE染色多少钱 2025-07-29
- 江苏推荐的HE染色多少钱 2025-07-29
- 吉林比较好的HE染色外包 2025-07-29
- 黑龙江结果客观的HE染色报告 2025-07-29
- 湖北病理HE染色报告 2025-07-29
- 河北仿真超薄活动义眼 2025-07-30
- 上海特优级FBS生产企业 2025-07-30
- 脊柱姿态 2025-07-30
- 普陀区质量实验仪器厂家电话 2025-07-30
- 采购步态评估系统大概价格 2025-07-30
- 金山区分析试剂生产企业 2025-07-30
- 湖南质量好的HE染色多少钱 2025-07-30
- 钱塘区哪些显微镜 2025-07-30
- 龙华区质量体外诊断试剂服务热线 2025-07-30
- 台州红绿光补偿无影灯 2025-07-30