进口布鲁克双光子显微镜作用
从双光子的原理和特点我们就可以明显的得出双光子的优点:☆穿透能力强:相对于紫外光,可见光和近红外光都具有更强的穿透能力,因而受生物组织散射的影响更小,解决对生物组织中深层物质的层析成像研究问题;☆高分辨率:由于双光子吸收截面很小,只有在焦平面很小的区域内可以激发出荧光,双光子吸收局限于焦点处的体积约为波长3次方的范围内;☆漂白区域小:由于激发只存在于交点处,所以焦点以外的区域都不会发生光漂白现象;☆荧光收集率高:与共聚焦成像相比,双光子成像不需要光学滤波器(共焦),这样就提高了对荧光的收集率,而收集率的提高直接导致图像对比度的提高。双光子显微镜能够在细胞甚至是亚细胞水平上对神经细胞的形态结构、离子浓度、细胞运动、进行直接成像监测。进口布鲁克双光子显微镜作用
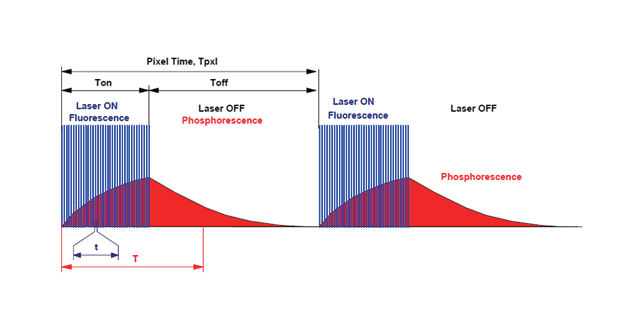
双光子荧光显微镜是结合了激光扫描共聚焦显微镜和双光子激发技术的一种新技术。双光子激发的基本原理是:在高光子密度的情况下,荧光分子可以同时吸收2个长波长的光子,在经过一个很短的所谓激发态寿命的时间后,发射出一个波长较短的光子;其效果和使用一个波长为长波长一半的光子去激发荧光分子是相同的。双(多)光子成像优势在于,具有更深的组织穿透深度,利用红外光,能够在层面检测极限达1mm的组织区域;因信号背景比高,而具有更高的对比度;因激发体积小,具有定点激发的特性,具有更少的光毒性;激发波长由紫外、可见光调整为红外激发,使其能够更加安全。2PPLUS双光子显微镜成像视野是多少双光子显微镜有这么多优点,那么双光子显微镜有哪些应用呢?

随着技术的发展,双光子显微镜的性能得到不断地优化,结合它的特点,大致可以分成深和活两个方面的提升。深要想让激发激光进入更深的层面,大致可从两个方面入手,装置优化与标本改造。关于装置优化,我们可以把激光束变得更细,使能量更加集中,就能让激光穿透更深。关于标本,其中影响光传播的主要是物质吸收和散射,解决这个问题,我们需要对样本进行透明化处理。一种方法是运用某种物质将标本浸泡,使其中的物质(主要是脂质)被破坏或溶解。另一种方法是运用电泳将脂质电解,让标本“透明度”提高。高光子密度带来的高能量容易损伤细胞,所以双光子显微镜使用高能量锁模脉冲激光器。这种激光器发出的激光具有很高的峰值能量和很低的平均能量,其脉冲达到最大值所持续的周期只有十万亿分之一秒,而其频率可以达到80至100兆赫,这样即能达到双光子激发的高光子密度要求,又能不损伤细胞,使扫描能更好地进行。
通过对显微光学系统的重新设计,将FHIRM-TPM2.0的成像视场扩展至420×420平方微米,显微物镜的工作距离扩展至1mm,实现无创成像。嵌入可拆卸的快速轴向扫描模块,实现深度180微米的三维体成像和多平面快速切换的实时成像。该模块由一个快速电动变焦镜头和一对中继镜头组成,在不同深度成像时保持放大率恒定。其中,变焦模块重1.8克,科研人员可以根据实验要求自由拆卸。此外,新型微型成像探头可以瞬间插拔,极大简化了实验操作,避免了长时间实验对动物的干扰。反复装卸探针追踪同批神经元时,视场旋转角度小于0.07弧度,边界偏差小于35微米。这种双光子显微镜的视场是普通显微镜的10倍。

共聚焦显微可以呈现这么漂亮的图像,是不是什么样品都可以用共聚焦显微镜拍拍拍.....得到各种各样清晰漂亮的图像呢?答案是否定的,任何事物都有优缺点,何况一台仪器呢,共聚焦显微镜也是有自己的局限,共聚焦有哪些局限呢:1.共聚焦显微镜只能拍摄约200um以内的的样品,对于厚的或者样品不能进拍摄;2.共聚焦显微镜由于是逐点进行扫描,对样品的光毒性还是比较大的,特别是拍摄活细胞样品时就更容易对样品进行淬灭;3.由于光照射的区域几乎能通过这个Z轴的层面,所以对于空间定点光刺激的实验定点位置就不是特别精确;并且激光共聚焦显微镜没有纯紫外进行激发,对于一些特殊激发波长的实验,效率非常低。双光子显微镜型号有哪些?进口双光子显微镜作用
双光子显微镜厂家就找滔博生物。进口布鲁克双光子显微镜作用
从双光子到三光子:科学家正在从双光子转向三光子显微镜。1996年,ChrisXu在康奈尔大学(Denk同导师实验室)读博期间发明了三光子显微镜,如果双光子吸收可行,那么三光子看起来也是自然的发展方向。三光子成像使用更长的波长,大约在1.3和1.7微米,其成像深度也比双光子更深,目前记录约为2.2毫米,人类大脑皮层厚约4毫米。相比双光子显微镜,三光子还要求以较低重频使用更强和更短的激光脉冲,而传统的钛宝石激光器难以达到这些要求,但是对于掺镱光纤飞秒光参量放大器则非常容易,比如我们的Y-Fi光参量放大器(OPA)。进口布鲁克双光子显微镜作用
- 美国荧光多光子显微镜能量脉冲 2025-06-24
- 进口膜片钳电压钳制 2025-06-24
- 美国多通道膜片钳实验操作 2025-06-24
- 芬兰脑片膜片钳单细胞 2025-06-24
- 进口单通道膜片钳离子通道 2025-06-24
- 芬兰可升级膜片钳脑片 2025-06-24
- 进口ultima双光子显微镜厂家电话 2025-06-23
- 双分子层膜片钳电生理工具 2025-06-23
- 模块化多光子显微镜多光子激发 2025-06-23
- 进口ultima2PPLUS双光子显微镜应用是什么 2025-06-23
- 四川室验分析电子天平厂家 2025-06-24
- 弱电工程光纤熔接机批发价 2025-06-24
- 温州乙醇分析气相色谱仪供应商 2025-06-24
- 天津静态称重模块应用 2025-06-24
- 闵行区质量减压阀保养 2025-06-24
- 合肥顶空气相色谱仪价格 2025-06-24
- 无锡大型金相砂轮切割机选型 2025-06-24
- 普陀区名优通讯设备平台 2025-06-24
- 广州进口光功率探头81623C 2025-06-24
- 福建智能型纤维直径检测设备行业应用案例 2025-06-24