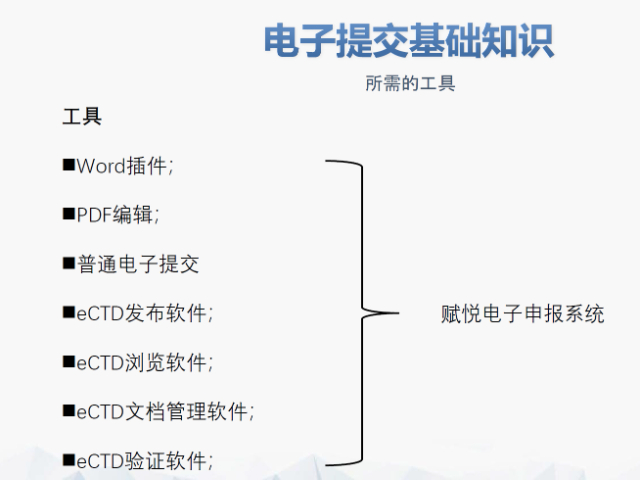
吴江区生物制品eCTD
审评效率与时间线优化 eCTD的标准化缩短了审评周期:集中程序平均审评时间从18个月降至12个月,互认程序可在90天内完成成员国意见协调。自动化验证工具减少了格式错误导致的退审率,但复杂药学数据的科学审评仍需较长时间。申请人可通过预提交会议(Pre-submission meeting)提前沟通技术细节,规避潜在延误。 区域协作与全球互认 欧盟通过互认程序与澳大利亚、加拿大等国实现eCTD数据共享,CEP证书在40余个非欧盟国家有效。然而,模块一区域信息的差异性仍要求申请人定制化调整,例如亚洲国家可能要求附加稳定性研究数据。ICH的协调作用有助于减少重复提交,但完全全球化仍需解决法规和技术壁垒。 技术工具与行业生态 主流eCTD编辑软件(如Lorenz、Extedo)支持欧盟区域模板的自动化生成,并与验证工具集成实现一键校验。云平台解决方案逐渐普及,支持多国团队协同编辑和实时版本控制。然而,软件采购和维护成本较高,中小企业常选择外包给专业服务商完成递交。美国API的DMF申报相关技术支持。吴江区生物制品eCTD
电子签章与传输安全 文件需经AES-256加密后刻录至不可擦写光盘,并附MD5校验码。光盘损坏或病毒污染将触发重递交流程,原载体按销毁程序处理。 ?审评与核查协同 自2018年起,FDA要求提交两套光盘分别用于审评和现场核查,2022年调整为“1套审评+1套核查+1套专项资料”模式,提升流程效率。 ?国际化兼容性增强 美国eCTD系统支持与欧盟、日本等地区的XML互操作性,但区域差异(如模块1的标签要求)仍需人工适配。 ?未来通道创 FDA计划引入API接口支持企业系统直连,并探索基于云存储的实时提交与审评,减少物理媒介依赖。国际注册eCTD发布软件澳大利亚NDA注册申报相关技术支持。

争议解决与法律救济 若申请人对审评结果有异议,可向EMA的CHMP申请重审查,或在欧盟法院提起行政诉讼。eCTD的完整提交记录可作为法律证据,证明申请人已履行合规义务。EDQM设立仲裁委员会,处理CEP程序中的技术争议。 行业趋势与竞争格局 全球eCTD服务市场年增长率达12%,欧盟占据35%份额,主要服务商包括PharmaLex、Certara等。头部药企通过自建IT团队降低成本,而中小型企业依赖外包以专注研发。人工智能(AI)在文件自动生成和审评意见预测中的应用逐渐增多。 患者参与与透明度提升 EMA通过公开eCTD摘要(如模块2.5临床概要)增强审评透明度,患者组织可提交意见影响审评决策。部分成员国要求模块1包含患者语言版本说明书,以提升用药依从性。未来,eCTD4.0或支持直接链接患者反馈平台,实现全生命周期互动。
美国eCTD的强制实施时间与范围:美国自2017年5月5日起要求药申请(NDA)、仿制药申请(ANDA)和生物制品许可申请(BLA)必须通过eCTD格式提交,2018年5月5日进一步扩展至临床试验申请(IND)和药品主文件(DMF)。FDA通过《联邦食品、药品和化妆品法案》第745A条明确电子提交的强制性,豁免非商业化IND和部分DMF类型(如Ⅲ类)。2023年数据显示,FDA接收的eCTD申请占比已达92%,标志着电子化审评体系的成熟。企业若未按规范提交(如缺少文件或重复序列号),将直接被拒收。欧盟eCTD注册咨询相关技术支持。
eCTD的实施为监管机构和企业带来了多重机遇。电子化申报资料能够极大地加速审评效率,减少人为判断错误和数据混淆的情况,从而提高审评的准确性和速度。同时,eCTD带来的数据标准化机遇使得全球监管机构的资料内容和电子格式得以统一,有助于在不同监管机构之间进行数据传输和共享。这对于提升全球监管效率和行业研发效率具有重要意义。 此外,eCTD的实施还促进了国际合作,构建了全球监管的底层大数据基础。对于企业而言,eCTD提供了一个规范化的研发活动模板,有助于降低与监管机构沟通的成本,提高申报效率。特别是对于国内的生物技术企业而言,eCTD的实施更是具有重要意义,有助于这些企业更好地走向国际市场。然而,中小企业在享受这些机遇的同时,也面临着技术和成本压力。eCTD的实施需要专门的团队进行系统维护和开发,这对于中小企业来说是一笔不小的开支。同时,数据安全问题也是企业关注的焦点。 此次CDE扩大eCTD实施范围对行业而言是一个积极的风向标。短期内,企业面临的挑战包括适应更高要求的技术规范并提高文件质量、和eCTD出版系统的磨合以及进行eCTD知识的跨职能培训等。 美国IND注册申报相关技术支持。合肥原料药eCTD
加拿大eCTD注册咨询相关技术支持。吴江区生物制品eCTD
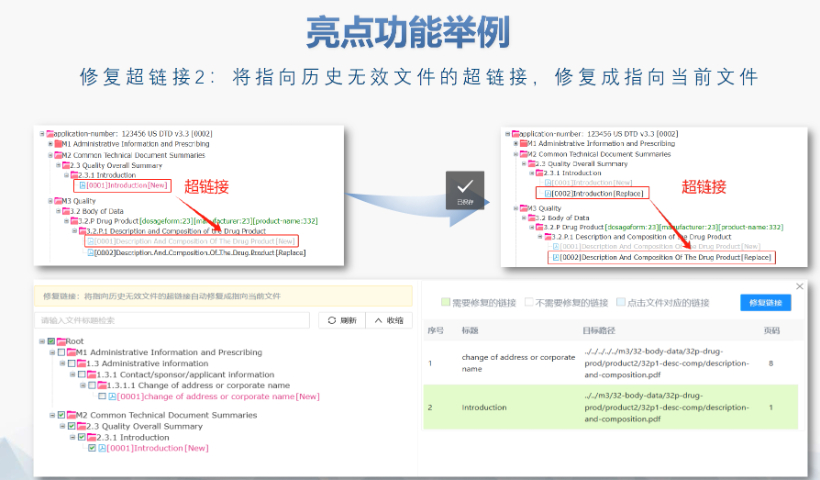
文件生命周期管理:eCTD支持文件替换(Replace)、删除(Delete)等操作,而非增文件。例如,更临床研究方案时需用Replace操作覆盖旧版本。基线提交(Baseline Submission)可用于补充历史纸质资料,但需在封面函中声明无内容变更。 临床数据与研究标签文件(STF):模块4和5中的研究数据需通过STF(Study Tagging Files)引用,确保数据与文档关联。FDA要求数据集(如SAS XPORT格式)能置于模块3-5,且单个文件超过4GB需拆分。2022年统计显示,58%的ANDA因研究数据技术拒绝标准(TRC)错误被拒。 电子签名与表格要求:FDA表格(如356h、1571)需使用数字签名,PDF文件禁止加密或设置编辑限制。电子签名需符合21 CFR Part 11规范,确保身份验证、不可否认性和数据完整性。 外包服务与系统解决方案:赋悦科技累计提交超2000份eCTD申请,外包可降低40%人工错误率。吴江区生物制品eCTD
赋悦科技(杭州)有限责任公司是一家有着雄厚实力背景、信誉可靠、励精图治、展望未来、有梦想有目标,有组织有体系的公司,坚持于带领员工在未来的道路上大放光明,携手共画蓝图,在浙江省等地区的数码、电脑行业中积累了大批忠诚的客户粉丝源,也收获了良好的用户口碑,为公司的发展奠定的良好的行业基础,也希望未来公司能成为*****,努力为行业领域的发展奉献出自己的一份力量,我们相信精益求精的工作态度和不断的完善创新理念以及自强不息,斗志昂扬的的企业精神将**赋悦科技供应和您一起携手步入辉煌,共创佳绩,一直以来,公司贯彻执行科学管理、创新发展、诚实守信的方针,员工精诚努力,协同奋取,以品质、服务来赢得市场,我们一直在路上!
- 高新区中国eCTD欢迎选购 2025-05-14
- 静安区生物制品eCTD使用 2025-05-14
- 芜湖新药eCTD是什么 2025-05-14
- 吴江区赋悦科技eCTD供应商 2025-05-14
- 南京生物制品eCTD注册系统 2025-05-14
- 上海化学药品eCTD格式 2025-05-09
- 南京电子申报eCTD哪个品牌好 2025-05-09
- 太仓NDAeCTD服务价格 2025-05-09
- 浦东新区原料药eCTD文件如何制作 2025-04-26
- 南京新药eCTD找哪家 2025-04-26
- 定制SaaS智能营销云平台怎么用 2025-06-04
- 白山自媒体营销推广特点 2025-06-04
- 福建家用工控机箱品牌 2025-06-04
- 机械关于互联网软件加盟报价 2025-06-04
- 惠山区多功能共享云桌面价格 2025-06-04
- 河北企业源代码加密费用 2025-06-04
- 北京应用KISSsoft参数 2025-06-04
- 宁波储能线束定制 2025-06-04
- 安徽海外商城开发 2025-06-04
- 海口文书录像带数据转换 2025-06-04