武汉哺乳动物纺锤体起偏器
尽管成熟卵母细胞纺锤体冷冻保存技术取得了进展,但仍面临一些挑战。首先,冷冻损伤仍然是制约其临床应用的主要问题之一。尽管玻璃化冷冻法能够在一定程度上减少冷冻损伤,但仍无法完全避免。其次,冷冻保存后的卵母细胞在体外受精和胚胎发育过程中的表现仍存在不确定性。这可能与冷冻过程中纺锤体和染色体的损伤有关,也可能与冷冻保护剂的残留毒性有关。此外,法律伦理问题也是卵母细胞冷冻保存技术面临的一大挑战。不同国家和地区对卵母细胞冷冻保存的法律和伦理规定各不相同,这在一定程度上限制了该技术的普及和应用。纺锤体形态的变化反映了细胞分裂的不同阶段。武汉哺乳动物纺锤体起偏器
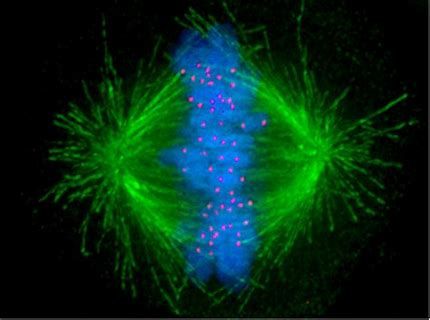
纺锤体,顾名思义,其形状类似于纺织用的纺锤,是在细胞分裂前初期到末期形成的一种特殊细胞器。它的主要元件包括微管、附着微管的动力分子分子马达,以及一系列复杂的超分子结构。微管是纺锤体的基础骨架,由αβ-微管蛋白二聚体组成,这些微管相互交错,形成纺锤状结构,将染色体紧密地联系在一起。在动物细胞中,纺锤体的形成和组装通常由中心体引导和控制。中心体是一个位于细胞质中的复合体,由两个中心粒嵌套在被称为pericentriolarmaterial(PCM)的区域内组成。PCM富含微管相关蛋白和其他蛋白质,如谷氨酸脱羧酶等微管主要蛋白,这些蛋白质共同协作,确保纺锤体的正确组装和稳定。相比之下,高等植物细胞的纺锤体并不包含中心体,而是由细胞极板附近的微管组织形成。昆明哺乳动物纺锤体胚胎植入纺锤体,作为细胞分裂的“引擎”,驱动着生命的延续与多样性。
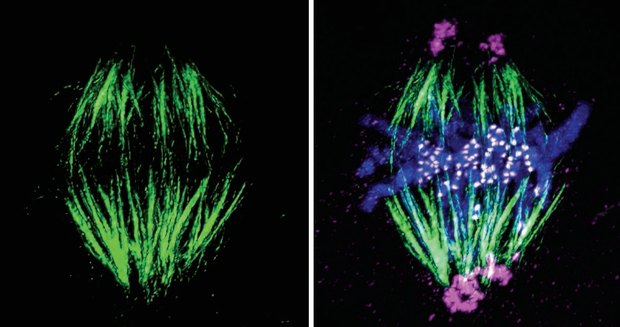
微管蛋白的突变和异常磷酸化是导致纺锤体功能障碍的主要原因之一。微管蛋白是构成微管的基本单元,其稳定性和功能对于纺锤体的组装和染色体的分离至关重要。微管蛋白的突变和异常磷酸化会影响微管的动态平衡,导致纺锤体的组装异常和染色体分离错误。纺锤体功能障碍会导致染色体不稳定,增加基因组的不稳定性。染色体不稳定会影响基因的表达和功能,导致细胞周期紊乱和细胞凋亡。在神经退行性疾病中,染色体不稳定会导致神经元的基因表达异常,进一步加剧神经元的损伤和死亡。
哺乳动物卵母细胞的纺锤体由微管组成,这些微管结构精细且高度动态,对温度、渗透压和机械力等外界因素极为敏感。在冷冻过程中,纺锤体容易因冰晶形成、渗透压变化或机械损伤而遭到破坏,导致染色体分离异常,进而影响卵母细胞的发育潜力和受精后的胚胎质量。选择合适的冷冻保护剂是减少纺锤体损伤的关键。然而,不同浓度的冷冻保护剂对纺锤体的影响各异,且不同哺乳动物种类之间也存在差异。因此,需要通过大量实验来优化冷冻保护剂的配方,以大限度地保护纺锤体的完整性。纺锤体的形成与消失是细胞周期中高度动态的过程。
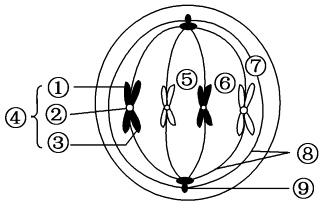
纺锤体的形成是一个复杂而精细的过程,涉及多种蛋白质的参与和调控。在有丝分裂的前间期,细胞进入S期,中心体开始复制倍增,为接下来的纺锤体形成做准备。进入G2期后,中心体完成复制,并在细胞进入分裂前期时分离,每个中心体各自形成放射状排列的微管,即星体。这些微管通过持续增加和丢失组成微管的微管蛋白亚基,实现微管的聚合和解聚,使纺锤体得以形成和维持。微管的组装和去组装过程受到多种调节蛋白的精确调控,如蛋白激酶、磷酸酶等。这些调节蛋白能够影响微管蛋白的聚合和解聚速率,从而控制纺锤体的形态和稳定性。此外,纺锤体的形成还依赖于动粒微管与染色体动粒的结合,这一过程由动粒上的驱动蛋白和动力蛋白介导,确保了染色体能够被纺锤体正确地捕获和牵引。纺锤体的研究对于理解遗传信息的传递和维持具有重要意义。美国MII期纺锤体液晶偏光补偿器
纺锤体的形成和功能与细胞的周期调控密切相关。武汉哺乳动物纺锤体起偏器
双折射性纺锤体卵冷冻研究涉及生殖医学、细胞生物学、材料科学等多个领域。未来,通过加强不同学科之间的交叉融合和协同创新,有望推动该领域取得更多突破性进展。随着技术的不断成熟和成本的降低,双折射性纺锤体卵冷冻技术有望在更多医疗机构中得到应用和推广。这将为更多女性提供生育能力保存的机会,同时也为生殖医学领域的发展注入新的活力。双折射性纺锤体卵冷冻研究是一项充满挑战与机遇的课题。通过不断优化技术、深化基础研究并推动临床应用与推广,我们有理由相信这一领域将在未来取得更加辉煌的成就。武汉哺乳动物纺锤体起偏器
- 上海1460 nm激光破膜组织培养 2025-05-17
- 上海哺乳动物纺锤体透明带 2025-05-17
- 上海MII期纺锤体胚胎植入 2025-05-17
- 昆明Hamilton Thorne纺锤体揭示卵母细胞关键结构 2025-05-17
- 香港MII期纺锤体厂家 2025-05-17
- 香港Hamilton Thorne激光破膜内细胞团分离 2025-05-17
- 香港成熟卵母细胞纺锤体改善分级 2025-05-17
- 上海MII期纺锤体价格 2025-05-17
- 武汉辅助生殖纺锤体加热台 2025-05-17
- 上海克隆纺锤体揭示卵母细胞关键结构 2025-05-17
- 浙江BIM-7402U 积分球型光电管功率计探测器销售 2025-05-17
- 奥林巴斯便携式XRF矿物探勘成分光谱分析仪 2025-05-17
- 云浮镜片批发 2025-05-17
- 四川臭氧色牢度测试仪性价比高 2025-05-17
- 上海实验室搬迁物流如何协调 2025-05-17
- 山东导波雷达液位计特点 2025-05-17
- 山西可靠性滴水试验装置供应商 2025-05-17
- 通用数显仪HZS-81-02-03-00生产 2025-05-17
- 江苏雷达物液位计价格 2025-05-17
- 浙江手持式多通道紫外成像仪商家 2025-05-17