天津临床前动物实验检测
为申请药品注册而进行的药物临床前研究,包括药物合成工艺、提取方法、理化性质及纯度、剂型选择、***筛选、制备工艺、检验方法、质量指标、稳定***理、毒理、动物药代动力学等。中药制剂还包括原药材的来源、加工及炮制等,生物制品还包括菌毒种、细胞株、生物组织等起始材料的来源、质量标准、保存条件、生物学特征、遗传稳定性及免疫学的研究等。根据药品注册申报资料要求,临床前研究可概括为3方面:(1)文献研究:包括药品名称和命名依据,立题目的与依据。(2)药学研究:原料药工艺研究,制剂***及工艺研究,确证化学结构或组份的试验,药品质量试验,药品标准起草及说明,样品检验,辅料,稳定性试验、包装材料和容器有关试验等。(3)药理毒理研究:一般药理试验,主要药效学试验、急性毒性试验,长期毒性试验,过敏性、溶血性和局部刺激性试验、致突变试验、生殖毒性试验、致*毒性试验,依赖性试验,动物药代动力学试验等。临床前药物安全性评价(DSE)是药物临床前研究的**内容。药物的安全性评价研究必须执行《药物非临床研究质量管理规范》(GLP)。化学药临床前动物实验机构;天津临床前动物实验检测

中成药临床前动物实验是在新药研发过程中,特别是在临床试验前的一个重要环节。这一实验的主要目的是评估中成药的安全性、有效性以及预测其在人体内的反应。具体来说,中成药临床前动物实验主要包括以下几个方面:安全性评估:动物实验可以帮助科学家了解中成药可能产生的副作用,识别潜在的毒性,从而确定是否适合进行后续的临床试验。有效性预测:通过动物实验,科学家可以初步判断中成药对特定疾病的疗愈效果,为后续的临床试验提供依据。剂量和给药途径探索:动物实验有助于确定在人体中比较合适的药物剂量和给药途径。重庆值得信赖临床前动物实验指标英瀚斯是专业的医疗器械临床前动物实验外包公司。
我国医疗器械临床前安全性评价还没有实施GLP管理,但要求开展医疗器械生物学评价试验机构需要具备中国合格评定国家认可委员会(ChinaNationalAccreditationServiceforConformityAssessment,CNAS)及中国计量认证(ChinaMetrologyAccreditation,CMA)认可的实验室资质,而对开展临床前动物实验研究还没有明确的资质要求。GLP管理与CNAS认证体系虽然是两个不同的质量管理体系,但基本内容有很多的相同性和相似性。如果参照我国相关医疗器械动物实验研究指导原则和国家或行业标准,在具备CNAS及CMA认可资质的实验室质量管理体系下开展医疗器械临床前动物实验研究,可以基本满足临床前动物实验研究质量管理要求。
临床前动物实验的目的主要是通过相关动物模型来考察产品的安全性和有效性,以及临床相关参数的确定,预测其在人群中使用时可能出现的不良事件,降低临床试验受试者和临床使用者承担的风险,并为临床试验方案的制定提供依据。动物实验研究作为初步验证医疗器械安全性及有效性的重要手段,动物实验的质量管理对保证动物实验研究数据的真实、可靠、准确、科学和完整至关重要。因此,研究机构需要加强对临床前动物实验的质量管理,监管部门也将不断加强对该领域的规范要求并加强科学监管。英瀚斯专业做临床前动物实验;
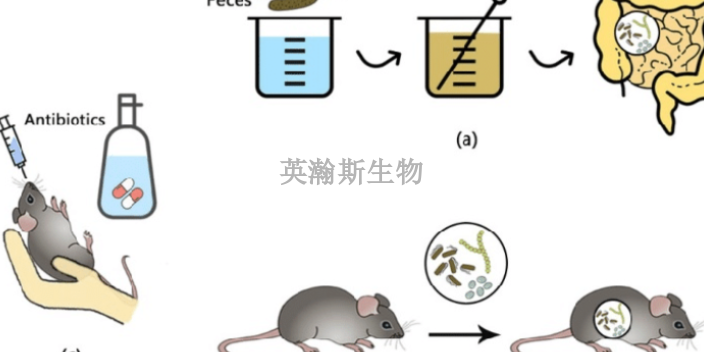
临床前动物实验中动物模型选择的思路应遵循以下原则:一是要大程度地模拟预期临床应用的实验系统,包括动物及其相关环境和生理特性。二是动物实验研究实施的合理性,风险分析要素应涉及为什么选择该动物模型。如果动物模型有局限性,器械的一些相关风险要通过实验室或者尸体实验进行评价,并确定其相关性。除此之外,还应确定实验系统的遗传学差异(动物和人的差异)。如实验系统和人的不同、器械的尺寸和输送系统差异、器械植入的部位和追踪方式差异,等等。医疗器械的安全性评估通常基于所提供有效科学证据的动物实验研究,应具有适当的标准操作规程,以确保数据的质量和完整性。研究机构应当制定与其业务相适应的标准操作规程。关于需要制定的标准操作规程可参考《药物非临床研究质量管理规范》第七章的合计15项条款。建议动物实验研究包括适当的控制措施以尽量减少实验的变异性和差错。这样的措施包括但不限于在试验过程中尽量减少影响实验动物的因素。生物药临床前动物实验指导原则;天津比较好的临床前动物实验多少钱
中成药临床前动物实验机构;天津临床前动物实验检测
关于临床前动物实验,资料显示,截至2012年7月,卫生部干细胞整顿工作办公室的调查结果是——干细胞***已经在我国300家左右的医院、机构开展。而国家干细胞工程技术研究中心主任、中国医学科学院血液学研究所研究员韩忠朝认为,300家医疗机构是个保守的数字,“这是卫生部开展的一个自查,自己报上的有300家,还有没有报上去的呢?实际肯定不止300家做”。事实上,除了造血干细胞***血液疾病以外,卫生部没有批准任何一家医疗机构用干细胞临床***任何一种疾病,全球的绝大多数干细胞研究都在临床前动物实验或临床阶段,只有加拿大在2012年5月份批准了美国一家公司生产的干细胞药物用于***移植物抗宿主病、日本iPS细胞实验自去年来得到**支持。天津临床前动物实验检测
- 贵州临床前动物实验价格 2025-05-30
- 四川个性化临床前动物实验检测 2025-05-30
- 山东什么是临床前动物实验机构 2025-05-30
- 四川个性化药效学外包 2025-05-29
- 江苏有什么临床前动物实验检测 2025-05-29
- 江西整体病理实验外包推荐 2025-05-29
- 天津推荐的病理实验外包服务 2025-05-29
- 江西专门做病理实验外包哪家靠谱 2025-05-29
- 临床前动物实验检测 2025-05-29
- 湖南大鼠免疫组化价格 2025-05-29
- 广州一次性CGT配件耗材设计开发 2025-05-30
- 济南th1th2细胞因子检测市场 2025-05-30
- 性价比高的培养基的图片 2025-05-30
- 本地分析试剂厂家电话 2025-05-30
- 北京陆桥培养基成分 2025-05-30
- 艾沙佐咪供货报价 2025-05-30
- 上海临床牙托粉 2025-05-30
- 成都高分子生物涂层是什么 2025-05-30
- 武汉便携式共享陪护床咨询 2025-05-30
- 子午流注***荨麻疹 2025-05-30